野良猫通信
国内外の食品安全関連ニュースの科学について情報発信する「野良猫 食情報研究所」。日々のニュースの中からピックアップして、解説などを加えてお届けします。
国内外の食品安全関連ニュースの科学について情報発信する「野良猫 食情報研究所」。日々のニュースの中からピックアップして、解説などを加えてお届けします。

東北大学薬学部卒、薬学博士。国立医薬品食品衛生研究所安全情報部長を退任後、野良猫食情報研究所を運営。
 畝山 智香子
畝山 智香子(前編「小林製薬の健康被害情報の過少報告問題(前)~アリストロキア酸の事例から考える」より続く)
日本政府は、2024年5月31日付で「紅麹関連製品に係る事案を受けた機能性表示食品制度等に関する今後の対応」方針を発表していて、その中の一つに「健康被害の情報提供の義務化」がありました。
その中で「事業者は、健康被害と疑われる情報を収集し、健康被害と疑われる情報を把握した場合は、当該食品との因果関係が不明であっても速やかに情報提供する」ことを求める、としていました。
この方針はメディアでも報道され、具体的な手続きや実効性はともかく、事業者から行政への速やかな情報提供の義務化は最低限必要なことだろうという雰囲気はあったと思います。ところが小林製薬はそのような状況下でも死亡に関する報告はしていなかったので、関係者は驚き呆れた、わけです。
結局は事業者が報告しなければ、報告していないことを外部から確認することはできないわけで、制度が始まる前から実効性に疑問が提示されたという状況です。
前編に続き、もう1つの参考として紹介するのは、前回のタラ粉末の事例で紹介したFDAに直接健康被害が報告されるシステム(食品安全応用栄養センター有害事象報告システムCFSAN Adverse Event Reporting System;CAERS)です。
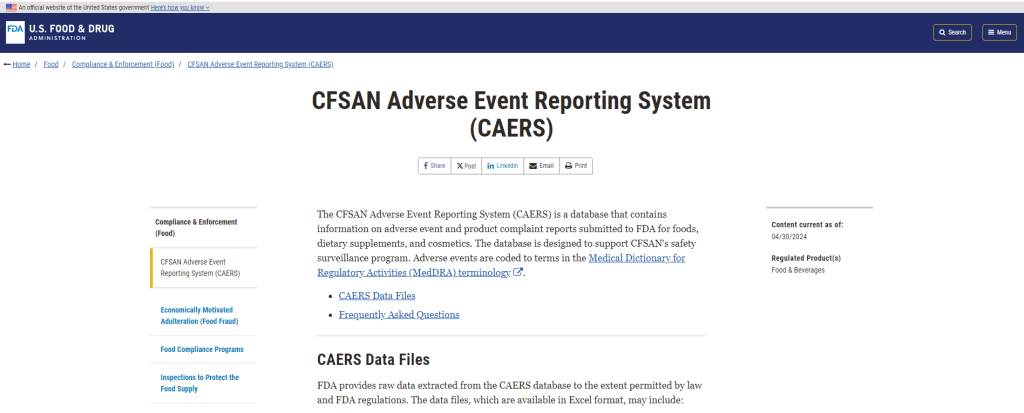
このシステムでは、食品、ダイエタリーサプリメント、化粧品に関する有害事象や製品への苦情を誰でも、つまり消費者でも医療従事者でも、本人でなくても家族でも、弁護士でも、直接報告することができます。
もちろん、消費者や医療従事者が製品の製造業者に有害事象を報告する場合もありますので、その場合は製造業者がCAERSに報告します。ほとんどの場合、報告は任意ですが、ダイエタリーサプリメントの場合に限ってはCAERSへの報告は義務です。
ここで用語に少し注意してください。もともと有害事象報告は医薬品や医療機器の安全性確保の分野で先行して進化してきた制度で、用語も医療分野と共通して使います。有害事象(Adverse Event)とは、「被験者に生じた好ましくない医療上のあらゆる出来事のことで治療との因果関係は問わない」、と定義されます。
一方、有害反応( Adverse Reaction)は「有害事象 のうち、治療との因果関係が否定できないもの」、となります。CAERSを含む有害事象報告システムで収集されるのはもちろん有害事象で、因果関係は関係なくとりあえず好ましくない出来事がおこったら報告してください、というものです。
薬を飲んでいた人が転んで骨折した、のような一見直接関係なさそうなことであっても、事例が多くなればその薬に骨を弱くしたり運動機能に影響したりする作用があるのではないかと疑うきっかけになる可能性があるからです。
CAERSではそれ以外にも製品の箱が壊れていた、味が変だったといった苦情も受け付けています。そうして集めた情報を、専門家が信頼性や報告の傾向などを検討して精査し、有害反応が生じている可能性があると判断すれば対応につなげるわけです。シグナルを検出するためにはまず多くの情報を集める必要があります。
CAERSの面白いところは、ダイエタリーサプリメントの事業者だけは報告が義務なので、もし消費者や医療従事者が事業者にも届け出たのに(報告できる人が多様なので一つの事象が重複して報告されることはあります、重複は削除すればいいので報告しないよりましです)、事業者からの報告がない場合には事業者の義務違反が発覚する可能性があることです。
そしてCAERSのデータファイルは一般向けに公開されています。2024年7月の時点では2004年1月から2023年12月までのexcelデータ25MBがダウンロードできます。22万件ほど記録されています。個人的には見ていて面白いのですが、一般の人がこれで何かを判断できるようなものではないと思いますし、これが原因で風評被害が生じるとは考えにくいです。
消費者庁の「機能性表示食品を巡る検討会」では、事業者が受け取った消費者からの多様な苦情をそのまま報告すると風評被害を招くといった主張が事業者側からなされていたように思います。
しかし小林製薬の報告遅れのような事態を防ぐためには、有害事象と有害反応は違うことを関係者が理解し、安全確保のためには幅広く情報を集める必要があることを消費者にも伝えて協力してもらわないといけないでしょう。
医薬品については、有害事象報告は当然のことで、膨大な報告があることはシステムが機能していることの証明でもあります。問題はできるだけ多くの情報をあげてもらうための広報や無償労働の提供依頼、膨大な量の報告を処理するシステム、有害事象の中から真の問題を発見できる専門能力のある人材などにどれだけリソースをかけられるか、でしょう。
結局のところ、安全性を確保するにはお金がかかるのです。安全のための投資を省略して簡単に機能性を宣伝して経済的利益を狙ったのが機能性表示食品制度ですが、結局どこかで「つけ」をはらうことになるわけです。

東北大学薬学部卒、薬学博士。国立医薬品食品衛生研究所安全情報部長を退任後、野良猫食情報研究所を運営。
 小林製薬の健康被害情報の過少報告問題(前)~アリストロキア酸の事例から考える
小林製薬の健康被害情報の過少報告問題(前)~アリストロキア酸の事例から考える  激辛ポテチ 海外では死者が出てリコールも
激辛ポテチ 海外では死者が出てリコールも 国内外の食品安全関連ニュースの科学について情報発信する「野良猫 食情報研究所」。日々のニュースの中からピックアップして、解説などを加えてお届けします。
