多幸之介先生の健康と食の講座
食や健康に関する間違った情報が氾濫し、食品の大量廃棄が行われ、無意味で高価な食品に満足する奇妙な消費社会。今、なすべきことは?
食や健康に関する間違った情報が氾濫し、食品の大量廃棄が行われ、無意味で高価な食品に満足する奇妙な消費社会。今、なすべきことは?

藤田保健衛生大学で臨床検査技師の養成教育に長年携わった後、健康食品管理士認定協会理事長に。鈴鹿医療科学大学教授も務める
 長村 洋一
長村 洋一小林製薬が製造している米紅麴を原材料とした錠剤型の機能性表示食品「紅麹コレステヘルプ」が原因とみられる被害が広がり、死者5人、入院患者114人(3月29日現在)、輸出国の台湾でも同じような患者がでており、非常に大きな事件となっている。
私はこうした事件が発生しないことを願って当協会(一般社団法人日本食品安全協会)を立ち上げ、17年余にわたり、それなりの活動を続けて来た。
今回の事件は私が過去に何度も取り上げ、業界紙にも訴えてきたGMP(適正製造規範)をしっかりすれば起こらなかったと言い切れると確信している。日本の健康食品に対するGMP制度は、国際的にみてガラパゴス化している。
医薬品の世界では、GMPを遵守して製品を作成すれば、次の基本3原則が確保されることが分かっている。
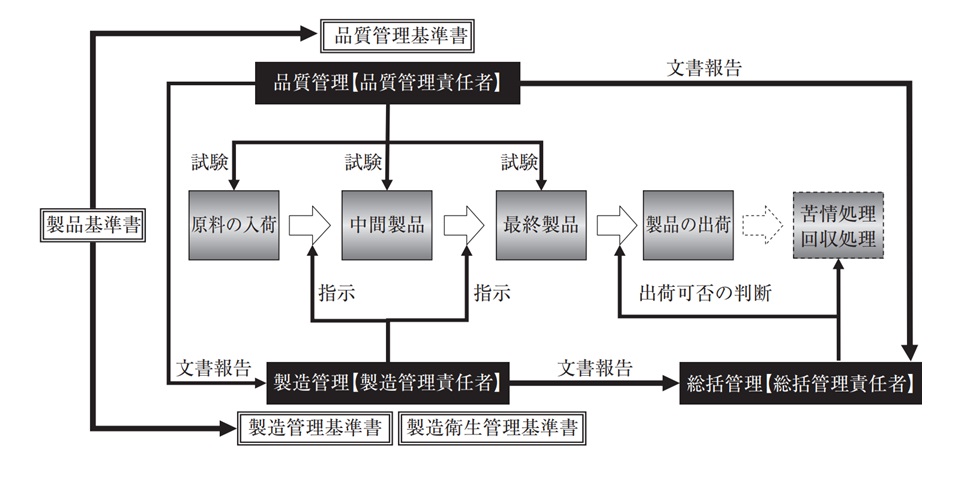
この図の中に「試験」という単語を3つ見ることができる。一番左の「原料の入荷」の部分の上の「試験」は、原料が申請したものと同じであるかどうかの試験である。3月29日の記者会見で、小林製薬は原料に新しいピーク(プベルル酸)が検出されたと言っていたので、紅麹関連製品もGMPを原材料の入荷時にチェックの試験が行われていれば、原料として除外できたと推測できる。
GMPがしっかり行われていればこの段階の分析データが残っているので、22日の会見の際に不純物の混入がありました、と言えるはずである。もし原料の段階で混入してなかったとしても、このあと2回の試験が待っているので、その後に混入したとしても振り返ってデータを調べれば発見できるはずである。
さらに1月に消費者からの訴えがあったときにGMPの記録を見れば、異常が発見できたと考えられる。それが3月29日になってもまだどこで混入したかもわからないのは、GMPにおける基本を行っていなかった小林製薬の管理が甘かったのは間違いがない。
こうした指摘をすると、小林製薬はいい加減な会社のような感じがするが、現行の制度としてみた場合、行うべきことは全てクリヤーしているので、私は業界の中では真面目な会社だと考えている。すなわち、真面目にやっても事故を発生させる素地を制度におけるGMPの在り方が有している、と判断すべきである。
現在の機能性表示食品制度発足の際に、GMPを厳しくすると企業が大変だ、という観点から非常に緩く制度が作られた。現在の制度で、機能性表示食品に対してGMPは望ましいという要求であり、どこまでやるかは企業任せになっている。制度そのものの甘さがあると私は考えている。実際、現在でまわっている機能性表示食品の20%位はGMPに準拠していない製品であり、GMPに対してはトクホも全く同じである。そしてたとえGMPマーク(後述)を取得していたとしても、今回のような事件を発生させるレベルの会社が多いのが現状である。
GMPは、もともと医薬品で事故を起こさないために開発された品質管理の手法であるので、医薬品の世界ではGMPに準拠して製造することが義務付けられている。したがって、微生物を利用した医薬品は数多く製造されてきているがこうした事故は発生していない。機能性表示食品制度が発足するとき、アメリカや諸外国が行っているのに唯一真似をしなかったのがGMP義務付けであるが、ここが非常に大きな間違いであった。
3年ほど前に福井県のある製薬会社が製造していた水虫の薬の原料に睡眠導入薬が混入していて2人の死者と245人の健康障害を発生させた事件があったが、発生させた過程の基本は小林製薬と全く同じである。すなわちGMP管理がいい加減だったことから生じた。
GMPが義務づけられている製薬業界でもGMPをいい加減に行えば、こうした事件を起こしてしまう。それは安全、という事故になるまではわからない部分で、会社としてはお金を掛けたくない仕事であるためである。最近はジェネリック医薬品製造業者のGMPに対する姿勢が悪く行政処分の対象になるケースが多発していることをGMP支援センターの平野和行理事長は危惧している。
ところでこのGMPであるが、錠剤、カプセル型のサプリにGMPを義務づけていないのは欧米先進国とASEANNを含めた国々の中で日本のみである。さらに健康食品GMPに関して言えば日本は非常に奇妙である。医薬品のGMPは義務づけられているから、GMPマークなどというレッテルはない。ところが日本には健康食品には2つのマークが存在し、そのマークが出せるのは厚生労働省の外郭団体とする法人が認めた団体のみである。
厚生労働省もこの制度を強く推奨して「GMPマークを目印に健康食品を選びましょう!」とホームページに出している。
しかし、GMPはマークではなく、どのように実行するかが重要であるので、外国への輸出を考えているしっかりした企業は我々のやっているGMP支援センターに指導を求めてくる。
改めて強調しておくが、GMPをしっかり遵守すればこうした事故は確実に防げるということである。そのGMP管理を行っていた会社が事件を起こした事実は、GMPマークが在ればよいのではなく、実行しなければならないことを意味している。
今回事件を起こした紅麴は機能性表示食品であるが、これは法律的には保健機能食品に属する。保健機能食品制度は、国民の食生活改善の補助手段としての日頃の食生活に加えて摂ることにより健康状態を良くする目的が主となっている。したがって、保健機能食品のトクホ、栄養機能食品、機能性表示食品のすべてに「食生活は、主食、主菜、副菜を基本に、食事のバランスを」との表示を義務付けている。私は、生鮮食品を含む一般食品に対してのこの制度は、世界に類のない素晴らしい制度だと考えている。
発足当初の特定保健用食品には、特別用途食品の許可要件の一つとして「原則として、錠剤型、カプセル型などをしていない通常の食品形態の食品であること」とされていたが、2001年の保健機能食品制度の創設後に削除された。トクホでは今まで健康障害として騒ぎ立てるような事件は発生していないのも特記すべき事項である。
事故をおこさない大きな原因は制度設立の趣旨に一般食品であることが強く要求されているので、現在市販されているトクホの大半が食品形態であるためである。最近少し錠剤タイプの製品が認められているが、これらに対する品質管理の要求レベルは機能性表示食品と同レベルなので今後は何が起こるかわからない。
そして2015年に保健機能食品に機能性表示食品が仲間入りした。この制度において商品の形態は一般食品である野菜、果物、穀類、魚などから一般加工食品やカプセル錠剤型まで認められることになった。トクホ制度の規制を緩和した感じのする機能性表示食品制度は日本独自の一般食品まで包含する良いアイデアの制度だと感じ、かなり応援をしていた。しかし今回の紅麹事件が発生し。錠剤、カプセル型のサプリにしっかりしたGMPを義務付けることの重要性を認識している。
巷には今回の事件は機能性表示食品制度がまずかった、トクホだったら安全性試験が国の審査で行われるからこんなことにならなかった、と発言される専門家がおられる。しかし、私は違うと思う。発酵食品のトクホもたくさんある中で、品質管理が悪かったら同じことが発生する可能性は大きい。今回の紅麹事件は、明らかに品質管理のまずさから発生した事件なのでトクホ、機能性表示食品などの分類に関係なく、保健機能食品の錠剤、カプセル型製品に対する品質管理に重点をおいた介入が必要と考えている。
機能性表示食品のガイドラインには機能性関与成分として以下のような注意書きがある。
「無承認無許可医薬品の指導取締りについて」(昭和46年6月1日付け薬発第476号厚生省薬務局長通知)の別紙「医薬品の範囲に関する基準」を参照し、「食薬区分における成分本質(原材料)の取扱いの例示」(令和2年3月31日付け薬生監麻発0331第9号厚生労働省医薬・生活衛生局監視指導・麻薬対策課長通知)の別添1「専ら医薬品として使用される成分本質(原材料)リスト」に含まれている成分でないことを確認している。
これは食薬区分問題であるが、この通達の意図するところは、医薬品を機能性表示食品としてはいけない、という意味であると判断している。ところが、前述のようにコレステヘルプは明らかに医薬品を含んでいる。実は機能性表示食品には同じように医薬品を含んでいて総称名で届け出が受理されている物が他にもある。こうした医薬品成分含有を認めながらGMPの義務付けもしないのは制度としての手落ちであると考えている。
私は個人的には現在の保健機能食品制度において生鮮食品を含めた一般食品に保健機能を表示できる制度は、トクホが創設されるときに掲げられた「食生活において特定の保健の目的で摂取する者に対し、その摂取により当該保健の目的が期待できる旨の表示をする食品」とあるように国民の食生活への介入手段のための日本独自の制度として強く支持してゆきたいと考えている。
以上のような流れの中で、今回のような事件の再発防止策としては、錠剤、カプセル型のサプリに対して国際的に大きな後れを取っている現状を鑑みて以下のような提案をしたい。
錠剤、カプセル型の食品をサプリメントまたは健康食品などの名称で何らかの新たな定義をし、サプリメント(健康食品)法を立法することを願いたい。そして生鮮食品を含む一般食品のみを保健機能食品として残してはどうであろうか。
こうすれば、諸外国のサプリメントとも整合性が取れる。ただ諸外国との整合性をとる場合は、医薬品のように消費者庁か厚生労働省が錠剤、カプセル型製品にGMPを義務付けることを世界に公表しなければならない。この公表が無いために現実に日本で先述のGMPマークを取得していても海外では認められなくてトラブルが発生している現状があるからである。
さらに安全にこうした制度を遂行するために我々アドバイザリースタッフに法的位置づけを与えて頂けば、その制度をしっかり遂行できる社会の実現が可能である。

藤田保健衛生大学で臨床検査技師の養成教育に長年携わった後、健康食品管理士認定協会理事長に。鈴鹿医療科学大学教授も務める
 改めてファクターXとして日本の食生活を考える
改めてファクターXとして日本の食生活を考える 食や健康に関する間違った情報が氾濫し、食品の大量廃棄が行われ、無意味で高価な食品に満足する奇妙な消費社会。今、なすべきことは?
