
九州大学農学部卒業後、食品会社研究所、業界誌、民間調査会社等を経て、現在はフリーの消費生活コンサルタント、ライター。
 森田 満樹
森田 満樹 4月1日施行の食品表示法のもとで、新たに導入される「機能性表示食品」制度。食品に機能性が表示できるものとして、特定保健用食品(トクホ)、栄養機能食品に続いて、第3のジャンルとなります。消費者庁が定めた一定のルールに基づき、事業者が科学的根拠について評価を行って消費者庁に届出を行い、要件が揃えば、事業者の責任で表示を可能となるものです。
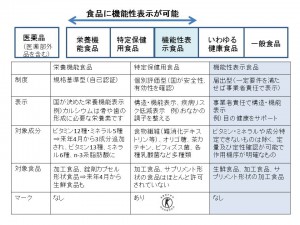
消費者庁では4月1日から届出を受け付け、届出から60日後には販売可能となります。早ければ6月頃には「機能性表示食品」と書かれた食品が市場に出てきます。新制度の対象は食品全般で、サプリメント形状の加工食品から生鮮食品まで、幅広いのが特徴です。現在でも売場にはトクホや栄養機能食品、いわゆる健康食品が並びますが、そこに機能性表示食品が加わります。

まずはどのようなイメージか、加工食品の事例を試作してみました。表示項目がたくさんありますが、主要面に表示された「機能性表示食品」ということばと、消費者庁への「届出番号」が目印となります。「機能性を示す表示」は後述しますが3種類あり、さらに「本品は、事業者の責任において特定の保健の目的が期待できる旨の表示を行うものとして、消費者庁長官に届出されたものです。ただし、特定保健用食品とは異なり、消費者庁長官による個別審査を受けたものではありません。」という打消し表示があります。こうした表示ルールが食品表示基準に示されています。制度の仕組みからみていきましょう。
●食品表示基準で義務表示項目が定められている

機能性表示食品の定義ですが、食品表示基準の第二条第一項十(p4)に図のように記されています。とても長い一文ですが、ここには、対象者、目的、対象食品などが記されており、表示内容、安全性、機能性、品質などの情報を販売日60日前に届け出るとしています。

義務付けられる表示項目は、加工食品は第三条2項(P26~30)、生鮮食品は第十八条2項(P102~106)に示されています。生鮮食品は本来は名称と原産地だけですが、これだけの表示が容器包装に必要となりますので中身が見えなくなってしまいそうです。これらの義務表示があるため、最初の図のように表示がぎっしりとなるのです。食品表示基準で示されるのは、食品表示に関する部分だけです。届出の際に求められる安全性、品質、機能性の情報はガイドラインで示されています。次にみていきましょう。
●ガイドラインで安全、品質、機能性の要件が定められている
2015年3月31日、「機能性表示食品の届出等に関するガイドライン」が消費者庁のウェブサイトで公表されました。ガイドラインは全部で111ページあり、対象食品になるかの判断、安全性の根拠、生産・製造及び品質の管理、健康被害の情報収集体制、機能性の根拠、表示の内容など、届出資料の作成に関する内容が示されています。最初の1ページに「構成」がコンパクトにまとめられており、これが目次がわりになります。
ガイドラインは2014年7月に公表された「食品の新たな機能性表示制度に関する検討会」の報告書がベースになっており、その内容を概ね反映して肉付けしたものになっています。そのポイントをまとめてみました。
【対象食品となるかの判断(P1~P4)】
機能性表示食品の対象となるかどうか、入口の段階での要件が示されています。
・疾病に罹患している者、未成年者、妊産婦(妊娠を計画している者を含む。)及び授乳婦を対象としていないか
・機能性関与成分として作用機序が明確であり、定量、定性確認が可能な成分か(別表1 p47に詳細)
・食事摂取基準が定められた栄養素でないか(なお、たんぱく質、n-6系脂肪酸、n-3系脂肪酸、食物繊維、ビタミンAの5成分の構成成分は機能性関与成分となりうる。たとえば各種アミノ酸、ペプチド、EPA、DHA、難消化デキストリンなど。)
・特別用途食品、栄養機能食品、アルコールを含有する飲料ではないか
・脂質、飽和脂肪酸、コレステロール、糖類、ナトリウム等の過剰摂取につながる食品ではないか
以上の要件を満たしたものがまずは対象となり、そこから下記の根拠が確認されることになります。
【安全性の根拠(P6~P16)】
1) 安全性評価に関するフローチャートが、P7に示されています。最初に、届出者はどの食品でも食経験があるかどうかをみます。ここで「いいえ」の場合は、公的機関のデータベースなどの2次情報を収集して安全性を確認し、さらに情報が不足している場合は文献(1時情報)を検索、安全性試験を実施するなど安全性の確認が求められます。
2) 機能性関与成分と医薬品の相互作用、機能性関与成分を複数含む場合はその相互作用の有無について、2次情報または1次情報からの安全性の確認が必要です。
【生産・製造及び品質の管理(P17~P21)】
サプリメント形状の加工食品またはその他の加工食品は、GMPやHACCPなどの衛生管理・品質管理の体制がとることが望ましく、管理体制の届出が求められます。生鮮食品も生産・採取、漁獲等の衛生管理体制が必要です。また、表示に記載された成分が含まれているか分析も求められます。機能性関与成分が質と量ともにきちんと含まれているか、品質の担保が求められることになります。
【健康被害の情報収集体制(P22~23)】
健康被害の発生の未然防止及び拡大防止を図るため、届出者は情報収集し行政機関への報告を行う体制の整備が求められます。
【機能性の根拠(P24~P34)】
次のいずれかによって、表示しようとする機能性の科学的根拠の評価が求められます。
1) 最終製品を用いた臨床試験:トクホと同等の水準の試験が求められます。試験の途中で都合の良いデータに変更されないよう、事前登録(UMIN臨床登録システムなどを利用)が必要となります。また、臨床試験の結果を適切に評価できるよう、国際的にコンセンサスが得られた指針(CONSORT2010声明:チェックリストはガイドラインの別紙2 p48~50)に準拠した査読付き論文を提出することも求められます。
2) 最終製品又は機能性関与成分に関する研究レビュー(システマティックレビュー):本制度で新たに取り入れられた科学的根拠を示す手法が、システマティックレビューです。1)のように試験をするのではなく、世の中に既にある論文についてデータベースを用いて予め設定した方法で抽出し、肯定的、否定的な結果をすべてあわせて総合的に機能性があるかどうかを評価するというものです。ガイドラインでは、この方法が細かく記されています。評価の過程は、他の人にも再現できるよう、全てのプロセスを整理して情報開示することが求められます。(システマティックレビューの実施手順例は別紙3 51~57)
【表示の内容(P35~P41)】
義務表示項目は前述したとおり食品表示基準の中にあり、詳細は今後、施行通知およびQ&Aで示すとしていますが、ここでは表示の留意事項についてまとめています。
ここでの最大のポイントは、上記の機能性評価について届け出た内容を表示する際に、どの方法で科学的根拠を評価したのかわかるよう表示をすることを求めたことで、下記の3つの構文が示されています。
ア 最終製品を用いた臨床試験で科学的根拠を説明した場合
例)「本品にはA(機能性関与成分)が含まれるので、Bの機能があります(機能性)」
イ 最終製品に関する研究レビューで科学的根拠を説明した場合
例)「本品にはA(機能性関与成分)が含まれ、Bの機能がある(機能性)ことが報告されています」
ウ 機能性関与成分に関する研究レビューで科学的根拠を説明した場合
例)「本品にはAが含まれます。AにはBの機能がある(機能性)ことが報告されています」
市場にはおそらく、ウの製品が多く出回ることになるでしょう。アの最終製品の臨床試験はトクホ並みのお金がかかり、イの最終製品の研究レビューは使える論文はそう多くはありません。ウは最終製品だけでなく機能性関与成分だけで科学的根拠が説明できるもので、その根拠が確かであればいろいろな食品に入れて届出をすることが可能です。
その3つの違いが、最も訴求ポイントである機能性表示に盛り込まれることになります。ウは一目でわかるように、二つの文章が「。」で区切られているのが特徴で、「報告されています」で文章が終わります。アのように一つの文で「機能があります」と言い切っていません。ウの表現をみたら、「企業が最終製品を用いてヒト試験をしたものではなく、いろんな論文を集めて評価して表示をしたもの」としてみてください。
ア、イ、ウの表示にみるように、機能性表示食品は何とも複雑です。利用する場合は、まずは容器包装の表示をよく読むことが大切ですが、さらに詳しく知りたいときは上記の届出内容が消費者庁のウェブサイトで情報開示されています。ガイドラインでは「容器包装への表示以外の情報開示」として必要事項が記され、別紙様式Ⅰ(P69~70)に「販売しようとする機能性表示食品の科学的根拠等に関する基本情報(一般消費者向け)」として示されています。届出の際に、一般消費者にわかりやすく適切な内容で示すことが、事業者責任として求められます。

●機能性表示食品の課題
以上、機能性表示食品の食品表示基準と、ガイドライン案のポイントをごくかいつまんでお伝えしました。食品表示基準では義務表示事項は多岐にわたり、ガイドライン案では科学的根拠を説明するためにたくさんの厳しい要件が盛り込まれていることがわかります。事業者責任といっても、好き勝手に表示できるわけではないのです。
しかし、懸念すべき点も数多くあります。消費者庁は届出の際に内容の形式的なチェックはしますが、なかみまでは審査しません。肝心の安全性や機能性の科学的根拠はガイドラインという位置づけで、法的には脆弱です。事業者責任に任されていますが、モラルの低い事業者が参入すれば、科学的根拠が確かでない「機能性表示食品」が数多く出回るでしょう。健康被害や経済被害も拡大して、市場が混乱する懸念もあります。消費者庁は監視指導を行うと言っていますが、体制は十分でしょうか。
「届出の内容が不適切な場合はちゃんと取り締まるのか」―この問いかけは、検討会や消費者委員会でも再三にわたって、委員から消費者庁に投げかけられてきました。消費者庁は「販売前から届出内容が情報開示されるので、様々な人の目に触れて不適切な部分があれば、届出の撤回もあり得る」としています。事業者責任で事後規制とは何とも心配です。情報開示という世界に類のないシステムですが、どこまで歯止めがかけられるでしょうか。
一方で、事業者が消費者庁のガイドラインを遵守しきちんと届出をすれば、健康食品を使っている消費者にとっては、メリットもあります。現在の健康食品市場は、機能性が表示できない「いわゆる健康食品」が大半で、様々な消費者問題を引き起こしています。この中から安全性、品質、機能性が確認された機能性表示食品に移行するものが増えれば、業界の健全化にもつながります。利用する消費者は情報開示された内容を精査しながら、選択できる機会を得ることができるでしょう。
それでも選択は自己責任に委ねられます。もし利用するのであれば、まずは制度をよく知り、そのうえで表示をよく読むこと。摂取をするうえでの注意事項など必ず目を通してください。そして、できれば消費者庁のウェブサイトで開示されている情報にアクセスすることをお勧めします。一般消費者向けに基本情報がわかりやすくまとめられており、難しい言葉も出てきますが慣れてくると「どんな科学的根拠に基づいて」「誰を対象に」「どのように摂取すると」「どんな効果があるのか」が説明されていることに気付くでしょう。
情報開示の内容からは企業姿勢も見えてきます。どの程度の論文データに基づくものか、製品によってかなり違うはずで、ここは責任感の強い企業だということもわかってくるはずです。また、こうした情報に触れることで、いわゆる健康食品の口コミ情報や動物実験などでのレベルの程度の理解も進むでしょう。自分にとってこの食品は必要が無いことにも気づくかもしれません。新制度を機会に、食品の科学的根拠に関するリテラシーも上がることにつながればいいとも思います。
新制度においては消費者自身の選ぶ力が問われることになります。食品表示や情報開示された内容を読み取るための力をサポートするために、消費者庁は消費者教育をどのように進めていくのか、企業がどのように情報を発信してコミュニケーションをしていくのか、それぞれの力が問われています。(森田満樹)

九州大学農学部卒業後、食品会社研究所、業界誌、民間調査会社等を経て、現在はフリーの消費生活コンサルタント、ライター。